

Delta Hainaut
7000 Mons
tél : 065/38.22.10
fax : 065/38.22.37
Secrétariat
Le triangle du feu
La réaction chimique de combustion ne peut se produire que si l'on réunit trois éléments : un combustible, un comburant, une énergie d'activation en quantités suffisante. On représente de façon symbolique cette association par le triangle du feu.
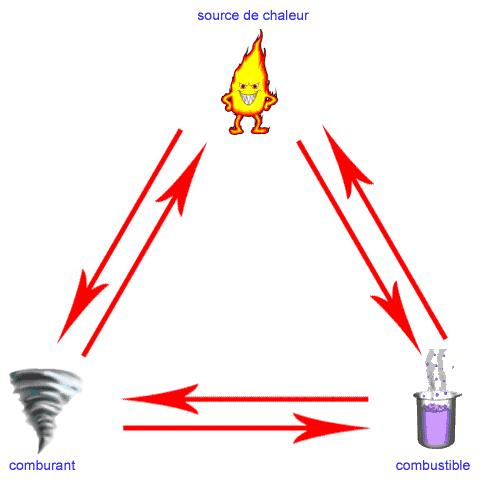
Le combustible
Le combustible est une matière qui, en présence d'oxygène et d'énergie, peut se combiner à l'oxygène (qui sert de comburant) dans une réaction chimique générant de la chaleur : la combustion.
La plupart des matériaux d'origine organique sont des combustibles. Par exemple, le bois, le charbon, le pétrole sont des combustibles.
Les différents types de combustibles :
La combustion des combustibles fossiles (pétrole, charbon, gaz...), issus de matières organiques préhistoriques fossilisées rejette dans l'atmosphère du dioxyde de carbone (CO2) qui provient de la combinaison d'atomes de carbone issus du sous-sol et d'oxygène atmosphérique.
Le comburant
Le comburant est l’autre réactif de la réaction chimique.
Un comburant est un corps chimique qui a pour propriété de permettre la combustion d'un combustible. Le principal comburant est le dioxygène.
Dans un feu, le dioxygène de l'air ambiant se mélange spontanément au combustible et la température de la flamme permet l'auto-entretien de la combustion.
A savoir : En privant un feu d’air, on l’éteint !
Principaux comburants :
L'énergie d'activation
L’énergie d’activation est le déclencheur du feu. Il s’agit généralement de chaleur. Par exemple, ce sera l’allumette que l’on frotte, le câble électrique qui chauffe, ou une autre flamme (propagation du feu), étincelle (de l’allume-gaz, de la pierre du briquet ou d’un appareil électrique qui se met en route ou s’arrête). Mais il y a d’autres façons de fournir l’énergie d’activation : électricité, radiation, pression… qui permettront toujours une augmentation de la température.
éditeur responsable : Serge Marlier, maintenance du contenu : Pierre-Yves Hainaut,
date mise à jour : 26-11-2007, s'identifier